感染 COVID-19 会导致肺部形成血栓,在严重的情况下可能是致命的,并带有严重后遗症的风险。 台湾中央研究院的研究人员发现,COVID-19 患者血栓形成的主要原因是 COVID-19 病原体 SARS-CoV-2 激活血小板以放大炎症反应,进而产生血栓。 阻断中性粒细胞表面的两种受体 CLEC5A 和 TLR2 可减轻血栓症状并减少血管内凝血和炎症。
该研究的第一作者、基因组学研究中心博士后研究员宋培山说,从 COVID-19 急性期患者采集的血液样本发现,血液中含有大量的细胞外囊泡(EVs),其中大部分来自血小板。 显然,这与遇到病毒后血小板的活化有关。 血小板被病毒激活后,会释放出大量细胞外类囊体刺激中性粒细胞,导致中性粒细胞大量胞外网络结构(NETs)和自杀性细胞死亡(NETosis)。 早期的研究发现,虽然 NETs 的形成有助于清除细菌,但过多的 NETs 会引发血栓,从而导致肺部微血管的阻塞。
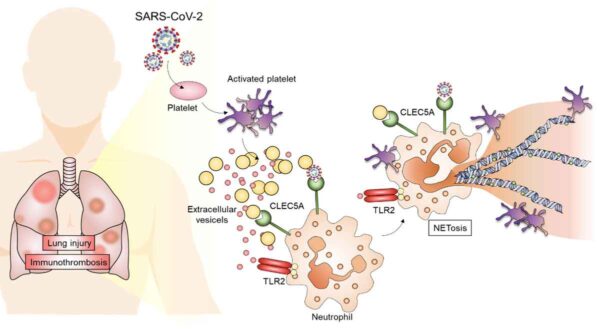 CLEC5A 和 TLR2 负责 SARS‑CoV‑2 诱导的 NET 形成(中央研究院基因组学研究中心)
CLEC5A 和 TLR2 负责 SARS‑CoV‑2 诱导的 NET 形成(中央研究院基因组学研究中心)研究小组对健康受试者和COVID-19患者的细胞外囊泡进行质谱分析,发现SARS-CoV-2感染引起的细胞外囊泡表达大量血小板相关蛋白,并具有多种血小板-与白细胞脱粒相关的相关蛋白。 血小板活化和聚集蛋白显示了 COVID-19 患者血液中血小板的强烈活化。
研究小组进一步培养了健康人和 COVID-19 中性粒细胞患者的细胞外囊泡。 结果显示,健康对照组的细胞外囊泡不能诱导NETs的形成,但COVID-19患者的细胞外囊泡诱导了NETs的形成。 通过阻断中性粒细胞表面的两种受体 CLEC5A 和 TLR2 来抑制强 NET 的形成。
在动物实验中,研究人员发现,小鼠在感染 SARS-CoV-2 病毒后 3 到 5 天,肺部会产生大量 NETs 和严重的细胞浸润; 在 CLEC5A 和 TLR2 敲除小鼠中,炎症和细胞浸润大大减少。
中央研究院基因组学研究中心杰出研究员谢士良指出,CLEC5A和TLR2是未来减少血栓性炎症和降低发生COVID-19后遗症风险的有希望的治疗靶点。
该研究已发表在《生物医学科学杂志》上。